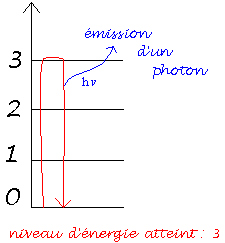
Lorsqu’un atome passe d’un niveau d’énergie En à un niveau inférieur d ‘énergie Ep un photon d’énergie hvnp est émis. Toute l’énergie que l’atome a perdu se retrouve dans le photon émis. Le principe de conservation de l’énergie appliqué à l’atome conduit à :
hvnp = En - Ep
De même, pour qu’un atome passe d’un niveau d’énergie Ep à un niveau d’énergie En supérieure, il faut lui fournir de l’énergie. Par exemple, il peut absorber un photon d’énergie hvnp , tel que :
hvnp = En - Ep
Mais on a aussi : En - Ep = hvnp = h.c!/!l
où v est la fréquence de l'onde lumineuse associée aux photons, h est la constante de Planck [h = 6,62 . 10-34 joule-seconde], c la vitesse de la lumière [3.10-8 m/s] et l la longueur d'onde.
En effet, à chaque transition électronique correspond l'émission d'un rayonnement de fréquence déterminée, sous la forme d'une raie lumineuse située dans le domaine du visible, de l'infrarouge ou de l'ultraviolet. En conséquence, chaque élément chimique génère un spectre de raies spécifique, qu'on pourrait assimiler à son "empreinte digitale".
(Voir le Spectre d'émission de l'hydrogène )
On peut ensuite connaître la période par la formule v = 1 / T et la longueur d'onde par la formule λ = c x T.
Cas de l'atome d'hydrogène :
L'énergie de l'atome d'hydrogène sur son nième niveau est : En = - Eo / n2 où E0 = 13,6 eV est l'énergie d'ionisation de l'atome. [1 eV = 1,6.10-19 J]

En 1913, Niels Bohr propose le modèle atomique qui porte son nom.